姜黄素,Curcumin ,(from Curcuma longa, ≥70%)
产品编号:Sigma-C1386| CAS NO:458-37-7| MDL NO:MFCD00008365| 分子式:C21H20O6 ;[HOC6H3(OCH3)CH=CHCO]2CH2| 分子量:368.37
Curcumin (Diferuloylmethane,姜黄素)是一种天然酚类化合物,同时也是特异性的乙酰转移酶 p300/CREB 结合蛋白抑制剂,能抑制组蛋白/非组蛋白的乙酰化,以及组蛋白乙酰转移酶(histone acetyltransferase)依赖的染色质转录。此外,Curcumin 对 NF-κb 和 MAPKs 有抑制作用,并能通过 Keap1 半胱氨酸修饰诱导 Nrf2 蛋白的稳定。具有抗炎、抗氧化、抗增殖和抗血管生成活性。
本网站销售的所有产品仅用于工业应用或者科学研究等非医疗目的,不可用于人类或动物的临床诊断或者治疗,非药用,非食用,
| 产品名称 | 姜黄素 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 英文名称 | Curcumin | |||||||||||||||||||||||||||||||||||||||||||||||
| CAS编号 | 458-37-7 | |||||||||||||||||||||||||||||||||||||||||||||||
| 产品描述 | Curcumin (Diferuloylmethane,姜黄素)是一种天然酚类化合物,同时也是特异性的乙酰转移酶 p300/CREB 结合蛋白抑制剂,能抑制组蛋白/非组蛋白的乙酰化,以及组蛋白乙酰转移酶(histone acetyltransferase)依赖的染色质转录。此外,Curcumin 对 NF-κb 和 MAPKs 有抑制作用,并能通过 Keap1 半胱氨酸修饰诱导 Nrf2 蛋白的稳定。具有抗炎、抗氧化、抗增殖和抗血管生成活性。 | |||||||||||||||||||||||||||||||||||||||||||||||
| 产品熔点 | 183 °C | |||||||||||||||||||||||||||||||||||||||||||||||
| 产品沸点 | 593.2±50.0 °C at 760 mmHg | |||||||||||||||||||||||||||||||||||||||||||||||
| 产品密度 | 1.3±0.1 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| 产品闪点 | 209.7±23.6 °C | |||||||||||||||||||||||||||||||||||||||||||||||
| 精确质量 | 368.125977 | |||||||||||||||||||||||||||||||||||||||||||||||
| PSA | 96.22000 | |||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 2.85 | |||||||||||||||||||||||||||||||||||||||||||||||
| 外观性状 | 橙色结晶粉末 | |||||||||||||||||||||||||||||||||||||||||||||||
| 蒸气压 | 0.0±1.8 mmHg at 25°C | |||||||||||||||||||||||||||||||||||||||||||||||
| 折射率 | 1.672 | |||||||||||||||||||||||||||||||||||||||||||||||
| 溶解性 | 不溶于水及乙醚, 溶于乙醇及冰醋酸。 | |||||||||||||||||||||||||||||||||||||||||||||||
| 溶解性数据 | In Vitro:
DMSO : 120 mg/mL (325.75 mM; Need ultrasonic) 配制储备液
*
请根据产品在不同溶剂中的溶解度选择合适的溶剂配制储备液;一旦配成溶液,请分装保存,避免反复冻融造成的产品失效。 In Vivo:
请根据您的实验动物和给药方式选择适当的溶解方案。以下溶解方案都请先按照 In Vitro 方式配制澄清的储备液,再依次添加助溶剂:
——为保证实验结果的可靠性,澄清的储备液可以根据储存条件,适当保存;体内实验的工作液,建议您现用现配,当天使用;
以下溶剂前显示的百
| |||||||||||||||||||||||||||||||||||||||||||||||
| 靶点 |
Keap1-Nrf2, Histone acetyltransferase[6] | |||||||||||||||||||||||||||||||||||||||||||||||
| 体外研究 | 姜黄素部分通过激活核因子(红细胞-2相关)因子2(Nrf2)及其抗氧化剂和II期解毒酶发挥其化学预防作用。姜黄素抑制T47D细胞生长,分别为24,48和72小时MTT测定的IC50为25,19和17.5μM。姜黄素和水飞蓟宾混合物对T47D细胞的IC50分别为17.5,15和12μM,暴露时间分别为24,48和72小时。姜黄素(2.5-80μM)诱导AGS和HT-29细胞系中的凋亡细胞死亡,并且在AGS和HT-29细胞系中IC50分别为21.9±0.1,40.7±0.5μM。姜黄素诱导的细胞凋亡需要AGS和HT-29细胞中的半胱天冬酶活性。姜黄素诱导ER Ca2 +下降和线粒体Ca2 +超载。姜黄素以剂量依赖性方式诱导LNCaP和PC-3细胞的G2 / M细胞周期停滞。姜黄素上调NF-κB抑制剂IkappaBalpha的蛋白质水平,下调c-Jun和AR的蛋白质水平[5]。 | |||||||||||||||||||||||||||||||||||||||||||||||
| 体内研究 | 与暴露于CMS的大鼠相比,姜黄素(10mg / kg,po)显着地防止了蔗糖消耗百分比的降低。姜黄素治疗可显着预防应激大鼠TNF-α和IL-6水平的升高。姜黄素以20mg / kg(ip)降低p300 / CREB结合蛋白(CBP)在脑源性神经营养因子(BDNF)启动子上的结合,降低40mg / kg的BDNF启动子处P300 / CBP的结合,和在慢性压迫性损伤(CCI)大鼠中,在60mg / kg的BDNF启动子处,p300 / CBP和H3K9ac / H4K5ac的所有四种蛋白质均降低[6]。 | |||||||||||||||||||||||||||||||||||||||||||||||
| 细胞实验 | T47D乳腺癌细胞系在补充有10%FBS,2mg / mL碳酸氢钠,0.05mg / mL青霉素G,0.08mg / mL链霉素的RPMI 1640中生长。将培养物保持在塑料烧瓶上并在37℃,5%CO 2中温育。在培养足够量的细胞后,通过24,48和72小时MTT测定研究水飞蓟宾和姜黄素的细胞毒性作用,其中在96孔板中培养1000个细胞/孔。在37°C和含5%CO2的潮湿气氛中孵育24小时后,用连续浓度的姜黄素(5,10,20,30,40,50,60,80,100μM),水飞蓟宾(20, 40,60,80,100,120,140,180,200μM)和姜黄素 - 水飞蓟宾混合物(每种都有5,10,20,30,40,50,60,80,100μM)24,48除了含有200μL含有10%DMSO的培养基的细胞用于对照之外,以一式四份的方式72小时和72小时。温育后,将平板的所有孔的培养基更换为新鲜培养基,并将细胞在培养箱中放置24小时。然后,小心地除去所有孔的培养基,并向每个孔中加入溶解在PBS中的50μL2mg/ mL MTT,并用铝箔覆盖该板并再次温育4.5小时。除去孔的内容物后,向孔中加入200μL纯DMSO。然后,加入25μLSorensen的甘氨酸缓冲液,并使用参考波长为630nm的EL×800微孔板吸光度读数器在570nm读取每个孔的吸光度。 | |||||||||||||||||||||||||||||||||||||||||||||||
| 动物实验 |
*下述溶液配置方法仅为基于分子量计算出的理论值。不同产品在配置溶液前,需考虑其在不同溶剂中的溶解度限制。
不同实验动物依据体表面积的等效剂量转换表(参考来源于公开文献)
例如,依据体表面积折算法,将化合物用于小鼠的剂量20 mg/kg 换算成大鼠的剂量,需要将20 mg/kg 乘以小鼠的Km系数(3),再除以大鼠的Km系数(6),得到化合物用于大鼠的等效剂量为10 mg/kg。 | |||||||||||||||||||||||||||||||||||||||||||||||
| 稳定性 | 1.按规格使用和贮存,不会发生分解,避免与氧化物接触 2.在酸性介质中呈淡黄色,在碱性介质中红褐色。耐还原性好,染着力强,对蛋白质着色力甚好,对光、热、氧及铁离子不稳定。 | |||||||||||||||||||||||||||||||||||||||||||||||
| 储存条件 | 密封保存,放置于通风、干燥地方,避免于其他氧化物接触。 |
相关文档
化学品安全说明书(MSDS)
下载MSDS质检证书(COA)
相关产品
| 符号 |

GHS07 |
|---|---|
| 信号词 | Warning |
| 危害声明 | H315-H319-H335 |
| 警示性声明 | P305 + P351 + P338 |
| 危害码 (欧洲) | Xi:Irritant |
| 风险声明 (欧洲) | R36/37/38 |
| 安全声明 (欧洲) | 26-36 |
| 危险品运输编码 | NONH for all modes of transport |
| WGK德国 | 2 |
| RTECS号 | MI5230000 |
| 海关编码 | 2932999099 |
| 产品名: | Curcumin |
| CAS号: | 458-37-7 |
| 制造商/供应商: | 西域试剂 网站:www.hzbp.cn 邮件:13911702513@139.com |
2. 合成/成分数据
| 产品名: | Curcumin |
| 别名: | Indian Saffron; Turmeric yellow; Natural Yellow 3; Diferuloylmethane |
| 分子式: | C21H20O6 |
| 分子量: | 368.38 |
3. 急救措施
| 吸入后: | 如果吸入,移至空气新鲜处,如果呼吸困难,给输氧,如呼吸停止,给予人工呼吸。 |
| 皮肤接触后: | 用大量的水冲洗,移除污染的衣服和鞋子。 |
| 眼睛接触后: | 检查并取下隐形眼镜,并用大量的水冲洗;呼叫医生。 |
| 吞食后: | 如果吞食,用大量纯净水漱口;呼叫医生。 |
4. 消防措施
| 适当的灭火剂: | 雾状水,二氧化碳,干粉或泡沫。 |
| 防护设备: | 穿戴自给式呼吸器和防护服,以防止与皮肤和眼睛接触。 |
5. 泄漏应急处理
| 安全防范措施: | 封锁泄漏区域;穿戴自给式呼吸器,防护服和厚橡胶手套。 |
| 清洁/收集措施: | 使用液体粘合原料(硅藻土,通用粘合剂)吸取精细粉末; 使用酒精擦洗表面和设备除去污渍; 根据第11条处理被污染的材料。 |
6. 处理和储存
| 安全处理说明: | 避免吸入和接触皮肤,眼睛及衣物;材料可能略微具有刺激性。 |
| 储存: |
粉末型式 -20°C 3年;4°C 2年 溶于溶剂 -80°C 6个月;-20°C 1个月 |
7. 接触控制和个人防护
| 呼吸设备: | NIOSH / MSHA认可的呼吸器。 |
| 双手保护: | 耐化学腐蚀的橡胶手套。 |
| 眼睛防护: | 化学安全护目镜。 |
8. 稳定性和反应活性
| 稳定性: | 按照说明存储是稳定的;避免强氧化剂。 |
| 热分解/其他要避免的情况: | 避免光和热。 |
9. 毒性资料
| 急性毒性: | 无可用资料。 |
| 主要刺激性影响: | 无可用资料。 |
| 在皮肤上: | 无可用资料。 |
| 对眼睛: | 无可用资料;可能具有刺激性。 |
10. 生态资料
| 一般注意事项: | 无可用资料。 |
11. 废弃处置
| 按照所在国家,省份,县市和地方的法规处置。 |
12. 运输信息
| 正确的运输名称: | 无 |
| 非危险品运输: | 这种物质被视为非危险品运输。 |
13. 法规信息
| 尚未有针对此产品作出的化学安全性评估。 |
14. 其他信息
| 这种化学品仅供受过训练的,有经验的研究人员在穿戴适当装备和授权允许的情况下进行操作处理。以上信息基于我们目前的知识被认为是正确的,但只适用于作为有经验人员的指导。请咨询您自己的安全顾问,并遵守当地和国家的安全法规。在任何其他没有被警告的情况下,并不意味着绝对没有危险存在。西域生物技术不承担任何使用这种化学品所造成的损害和责任。2023 西域生物技术版权所有。 |
|
~91% 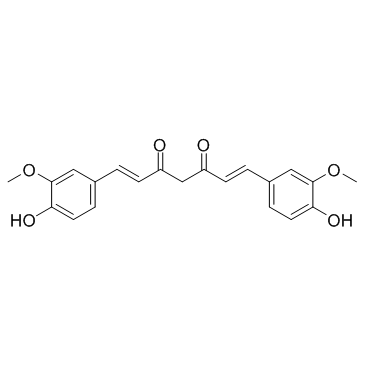
458-37-7 |
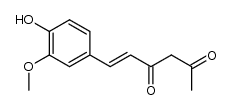
| 文献:Journal of Agricultural and Food Chemistry, , vol. 57, # 22 p. 11041 - 11046 |
|
~% 
458-37-7 |
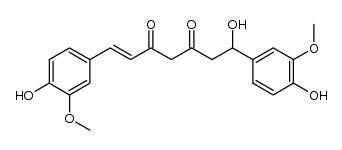
| 文献:US2006/160812 A1, ; Page/Page column 2 ; |
|
~% 
458-37-7
详细
|
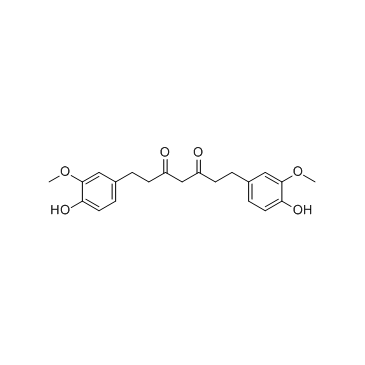
| 文献:Journal of Natural Products, , vol. 61, # 12 p. 1531 - 1534 |
|
~% 
458-37-7
详细
|
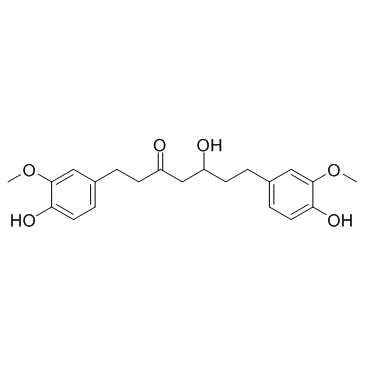
| 文献:Journal of Natural Products, , vol. 61, # 12 p. 1531 - 1534 |
|
~% 
458-37-7
详细
|
| 文献:Journal of Natural Products, , vol. 61, # 12 p. 1531 - 1534 |
|
~7% 
458-37-7 |
| 文献:Bioorganic and Medicinal Chemistry Letters, , vol. 24, # 2 p. 685 - 690 |
|
~% 
458-37-7 |
| 文献:Medicinal Chemistry Research, , vol. 20, # 4 p. 503 - 510 |
|
~% 
458-37-7 |
| 文献:Chemical & Pharmaceutical Bulletin, , vol. 35, # 8 p. 3298 - 3304 |
| 上游产品 5 | |
|---|---|
| 下游产品 8 | |
- 39. Ni, Wenfeng, et al. "Dual-targeting nanoparticles: codelivery of curcumin and 5-fluorouracil for synergistic treatment of hepatocarcinoma." Journal of pharmaceutical sciences 108.3 (2019): 1284-1295.https://doi.org/10.1016/j.xphs.2018.10.042
- 38. Cai, Mengru, et al. "Amino-functionalized Zn metal organic frameworks as antitumor drug curcumin carriers." New Journal of Chemistry 44.41 (2020): 17693-17704.DOI https://doi.org/10.1039/D0NJ03680C
- 37. Chen, Xiumin, Yanfang Yang, and Yingtao Zhang. "Isobavachalcone and bavachinin from Psoraleae Fructus modulate Aβ42 aggregation process through different mechanisms in vitro." Febs Letters 587.18 (2013): 2930-2935.https://doi.org/10.1016/j.febslet.2013.07.
- 36. Yu, Yun-Bo, et al. "Constructing biocompatible carboxylic curdlan-coated zein nanoparticles for curcumin encapsulation." Food Hydrocolloids 108 (2020): 106028https://doi.org/10.1016/j.foodhyd.2020.106028
- 35. Zeng, Yibin, et al. "Curcumin against imiquimod-induced psoriasis of mice through IL-6/STAT3 signaling pathway." Bioscience reports (2020).https://doi.org/10.1042/BSR20192842
- 34. Li, Pan, et al. "Curcumin metabolites contribute to the effect of curcumin on ameliorating insulin sensitivity in high-glucose-induced insulin-resistant HepG2 cells." Journal of ethnopharmacology 259 (2020): 113015.https://doi.org/10.1016/j.jep.2020.113015
- 33. Sun, M. X., et al. "Effects of curcumin on the role of MMP-2 in endometrial cancer cell proliferation and invasion." Eur Rev Med Pharmacol Sci 22.15 (2018): 5033-5041.
- 32. Weng, Qingxia, et al. "Fabrication of self-assembled Radix Pseudostellariae protein nanoparticles and the entrapment of curcumin." Food chemistry 274 (2019): 796-802.https://doi.org/10.1016/j.foodchem.2018.09.059
- 31. Liu, Gang, et al. "Maillard-reacted whey protein isolates and epigallocatechin gallate complex enhance the thermal stability of the pickering emulsion delivery of curcumin." Journal of agricultural and food chemistry 67.18 (2019): 5212-5220.https://doi.org
- 30. Huang, Meigui, et al. "Liposome co-encapsulation as a strategy for the delivery of curcumin and resveratrol." Food & function 10.10 (2019): 6447-6458.https://doi.org/10.1039/C9FO01338E
- 29. Liu, Zhenhong, et al. "GAPT regulates cholinergic dysfunction and oxidative stress in the brains of learning and memory impairment mice induced by scopolamine." Brain and behavior 10.5 (2020): e01602.https://doi.org/10.1002/brb3.1602
- 28. Yan, Jing-Kun, et al. "Biocompatible polyelectrolyte complex nanoparticles from lactoferrin and pectin as potential vehicles for antioxidative curcumin." Journal of agricultural and food chemistry 65.28 (2017): 5720-5730.https://doi.org/10.1021/acs.jafc.7b
- 27. 纪万里,周泽华,王婷婷,安叡,梁琨,王新宏.基于UPLC-LTQ-Orbitrap-MS方法分析半夏泻心汤化学成分[J].药物分析杂志,2020,40(10):1736-1750.
- 26. 李浩铭,黄永杰,王永丽,李大鹏,李锋.姜黄素及其代谢修饰产物对PC12细胞氧化损伤的保护作用[J].食品科学,2020,41(15):208-215.
- 25. 刘啸昂,唐辉,刘盼盼,卢志雄,陈文.姜黄素对HepG2细胞脂质沉积的改善作用及机制研究[J].上海中医药大学学报,2021,35(01):50-54.
- 24. 赵文平, 贾龙刚, 路福平,等. 基于β-内酰胺酶构建大肠杆菌体内Aβ42聚集抑制剂筛选体系[J]. 食品与发酵工业, 2019, 45:17-24.
- 23. 刘佳慧, 王修俊, 郑君花,等. 酶法-微波法联合提取贵州生姜中姜黄色素及其定性分析[J]. 保鲜与加工, 2016(3):61-66.
- 22. 李浩铭,黄永杰,王永丽,李大鹏,李锋.姜黄素及其代谢修饰产物对PC12细胞氧化损伤的保护作用[J].食品科学,2020,41(15):208-215.
- 21. 黄阳,许美玉,黄群,安凤平,滕慧,王艺伟.蛋清粉为壁材的姜黄素微胶囊的制备[J].粮食科技与经济,2016,41(01):59-62.
- 20. 冯藜枥, 曹文富, 叶凤. 莪术含药血清抑制大鼠HSC中Glil和β-catenin表达的机制研究[J]. 重庆医科大学学报, 2017, 042(003):308-314.
- 19. 徐艳,张心怡,狄留庆,樊文玲.热熔挤出技术制备热敏性姜黄素固体分散体的研究[J].中草药,2018,49(17):4014-4021.
- 18. 郑君花, 王修俊, 王丽芳,等. 姜黄色素的稳定化研究[J]. 食品科技, 2015, 040(001):287-291.
- 17. 刘乐环, 茅玉炜, 黎翊君,等. 姜黄素炎症靶向自微乳的制备及质量评价[J]. 世界科学技术-中医药现代化, 2016(12).
- 16. 朱雯洁, 黄莉君, 叶曾联,等. 姜黄素微球制备工艺研究[J]. 广州化工, 2017, 45(023):66-68.
- 15. 张艳莉, 张彤. 姜黄素对高氧诱导的新生小鼠视网膜病变及notch通路的影响
- 14. 李旭炯,刘安,陈云霞,李淑芬.姜黄素对肝肺综合征大鼠的保护作用[J].中国临床药理学与治疗学,2017,22(07):738-742.
- 13. 辛华,江源铭,马雷,任秀英,王莉,刘金凤,江清林.姜黄素对前列腺癌细胞C-erbB-2、Bax和Survivin表达的影响[J].中医药信息,2018,35(01):16-18.
- 12. 钟宇, 黄琼林, 莫明明,等. 姜黄素对H_2O_2诱导的HT29细胞氧化损伤的保护作用及机制研究[J]. 天然产物研究与开发, 2019, v.31(03):33-39.
- 11. 刘国安, 许欣欣, 李贵琛,等. 姜黄素在生化和细胞体系的抗氧化与促氧化作用[J]. 西北师范大学学报(自然科学版), 2020, 056(003):82-89.
- 10. 钱伟伦, 高修滨, 于志文,等. 姜黄素中枢给药对胰岛素抵抗小鼠的改善作用及其机制研究[J]. 福建中医药, 2019, v.50;No.327(02):34-36+42.
- 9. 邢永娜, 冯进, 李春阳. 姜黄素与白首乌蛋白以及大豆分离蛋白相互作用的比较[J]. 食品科学, 2020, v.41;No.623(10):62-69.
- 8. 施元旦, 刘玲. 姜黄素-茶氨酸共无定型复合物的制备与生物利用度研究[J]. 现代中药研究与实践, 2019, 033(005):47-53.
- 7. 陆佳璐, 邓丽娜. 姜黄素-色氨酸共无定型的制备及其在大鼠体内的药动学研究[J]. 中国药房, 2019(17):2348-2354.
- 6. 陆昕怡, 韩加伟, 李文,等. 姜黄素/胡椒碱固体分散体的制备及体外评价[J]. 现代中药研究与实践, 2018, 032(003):49-53.
- 5. 黄容, 陆昕怡, 韩加伟,等. 姜黄素-胡椒碱固体分散体的制备与生物利用度研究. 中草药.
- 4. 石淑先, 李庆钊, 陈晓农,等. 姜黄素/聚(α-氰基丙烯酸异丁酯)载药微球的制备及其药物释放[J]. 生物医学工程学杂志, 2018, 035(005):749-753.
- 3. 刘晓静, 贾竞夫, 孙丽芳,等. 基于超临界CO_2抗溶剂技术的姜黄素固体脂质纳米粒研究[J]. 中药材, 2019, v.42;No.425(07):168-171.
- 2. 李照雪,胡思远,王吉烨,陈泽慧,张闪闪,张波.基于促甲状腺功能的姜黄素延长低温冷冻小鼠生存时间的作用机制研究[J].中国药理学通报,2017,33(09):1291-1297.
- 1. 陈佳 江雅琴 李伟 王艳平.3种中药活性成分对耐多药鲍曼不动杆菌的体外抑菌作用[J].中国药业 2018 27(08):12-14.







 浙公网安备 33010802013016号
浙公网安备 33010802013016号