葡萄糖氧化酶,Glucose Oxidase (Type II, 15,000-25,000 Units/G)
产品编号:Sigma-G6125| CAS NO:9001-37-0| MDL NO:MFCD00131182| 分子式:Null,without related properties.| 分子量:Null,without related properties.
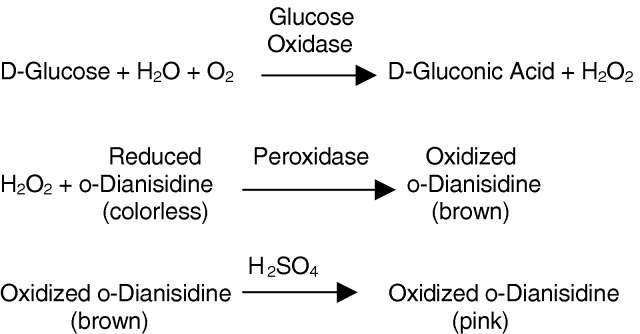
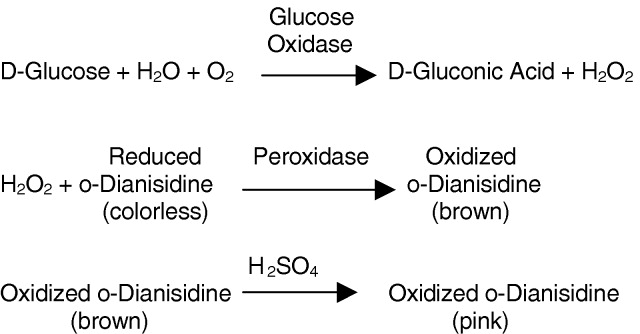
Glucose oxidase(GOD,葡萄糖氧化酶)是一种氧化还原酶,能通过与细胞内的氧气 (O2)和β-D-葡萄糖反应,生成过氧化氢 (H2O2) 和葡萄糖酸,从而切断癌细胞的营养来源,抑制癌细胞的增殖。
本网站销售的所有产品仅用于工业应用或者科学研究等非医疗目的,不可用于人类或动物的临床诊断或者治疗,非药用,非食用,
| 产品名称 | 葡萄糖氧化酶 |
|---|---|
| 英文名称 | Glucose Oxidase (Type II, 15,000-25,000 Units/G) |
| CAS编号 | 9001-37-0 |
| 产品描述 | Glucose oxidase(GOD,葡萄糖氧化酶)是一种氧化还原酶,能通过与细胞内的氧气 (O2)和β-D-葡萄糖反应,生成过氧化氢 (H2O2) 和葡萄糖酸,从而切断癌细胞的营养来源,抑制癌细胞的增殖。 |
| 产品沸点 | 513.7±50.0 °C at 760 mmHg |
| 产品密度 | 1.5±0.1 g/cm3 |
| 产品闪点 | 226.8±23.6 °C |
| 精确质量 | 154.026611 |
| LogP | -0.75 |
| 外观性状 | 黄色粉末 |
| 蒸气压 | 0.0±3.0 mmHg at 25°C |
| 折射率 | 1.603 |
| 溶解性 | 易溶于水,完全不溶于乙醚、氯仿、丁醇、吡啶、甘油、乙二醇等有机溶剂,50%丙酮、66%的甲醇能使其沉淀。 |
| 溶解性数据 | In Vitro:
H2O : 50 mg/mL (Need ultrasonic) In Vivo:
请根据您的实验动物和给药方式选择适当的溶解方案。以下溶解方案都请先按照 In Vitro 方式配制澄清的储备液,再依次添加助溶剂:
——为保证实验结果的可靠性,澄清的储备液可以根据储存条件,适当保存;体内实验的工作液,建议您现用现配,当天使用;
以下溶剂前显示的百
*以上所有助溶剂都可在西域网站选购。
|
| 靶点 |
Microbial Metabolite |
| 体外研究 | 葡萄糖氧化酶是氧化还原酶的一个子类,对电子从氧化剂转移到还原剂进行催化。葡萄糖氧化酶利用氧作为外部电子受体,释放过氧化氢(H2 O2)。葡萄糖氧化酶在商业加工中有许多应用,包括改善颜色和味道,增加食物材料的持久性,去除干鸡蛋中的葡萄糖,以及消除不同果汁和饮料中的氧气。 |
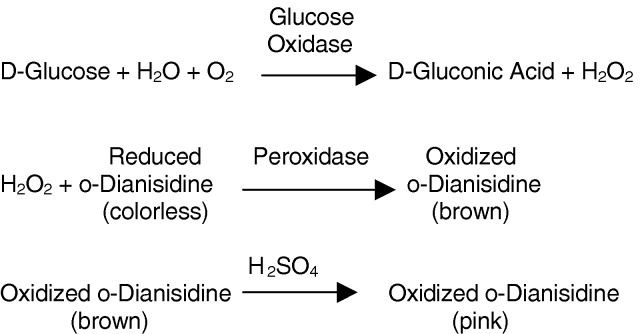
| 稳定性 | 1.一般商品都含有过氧化氢酶,每摩尔酶蛋白含2摩尔黄素腺嘌呤二核苷酸(FAD)。酶反应:β-D-葡萄糖+H2O+O2→D-葡萄糖酸-1,5-内酯+H2O2,最适pH5.5~5.8。最适温度30~35℃。等电点pI4.2~4.3。最大吸收波长377、455nm。抑制剂有银(Ag+)、汞(Hg2+)、铜(Cu2+)。酸、碱和高温使其失活。在紫外光下无荧光,但在高温、酸或碱处理后具有FAD特殊绿色。 |
| 储存条件 | 4℃密封干燥保存。溶液应防止冻结 |
相关文档
化学品安全说明书(MSDS)
下载MSDS质检证书(COA)
相关产品
| 符号 |

GHS08 |
|---|---|
| 信号词 | Danger |
| 危害声明 | H334 |
| 警示性声明 | P261-P342 + P311 |
| 个人防护装备 | dust mask type N95 (US);Eyeshields;Faceshields;Gloves |
| 危害码 (欧洲) | Xn,Xi |
| 风险声明 (欧洲) | 42-36/37/38 |
| 安全声明 (欧洲) | 45-22-23-36-26-24/25 |
| 危险品运输编码 | NONH for all modes of transport |
| WGK德国 | 1 |
| RTECS号 | RQ8452000 |
| 海关编码 | 35079090 |
- 111. [4.501] Ying Zhang et al."MOF-Based G−Quadruplex/Hemin DNAzymes for Cascade Reaction."Catalysts.2023 Jan;13(1):81
- 93. [IF=6.321] Guangqu Liu et al."Multivesicular Liposomes for Glucose-Responsive Insulin Delivery."Pharmaceutics. 2022 Jan;14(1):21
- 92. [IF=5.875] Yu Cheng et al."FC-BBR/IND-induced glucose oxidase nanodrugs for targeted combination therapy."Int J Pharmaceut. 2022 Jan;611:121349
- 67. [IF=4.821] Yan Niu et al."A “turn-on” fluorescent probe for ultra-sensitive detection of β-galactosidase."Microchem J. 2021 Jul;166:106205
- 48. [IF=16.806] Jiangang Liu et al."A Biomimetic Plasmonic Nanoreactor for Reliable Metabolite Detection."Adv Sci. 2020 May;7(10):1903730
- 40. [IF=5.339] Dongqin Yang et al."A nanocluster-based fluorescent sensor for sensitive hemoglobin detection."Talanta. 2017 Aug;170:233
- 30. [IF=13.281] Ming-Kang Zhang et al."Tumor Starvation Induced Spatiotemporal Control over Chemotherapy for Synergistic Therapy."Small. 2018 Dec;14(50):1803602
- 29. Zhang, Fangmei, et al. "Dopamine-modified Mn-doped ZnS quantum dots fluorescence probe for the sensitive detection of tyrosinase in serum samples and living cells imaging." Sensors and Actuators B: Chemical 256 (2018): 1069-1077.https://doi.org/10.1016/j.s
- 28. Dan Li, Yanxiao Jiang, Sihan Chen, Qingnan Zhao, Yue Zhang, Wei Wang, Ying Sun, Pinyi Ma, Daqian Song, Xinghua Wang, A simple and sensitive assay of alkaline phosphatase activity in serum by fluorescent silicon nanoparticles based on inner filter effect, S
- 27. Wang, Yan, et al. "Hemin-porous gC 3 N 4 hybrid nanosheets as an efficient peroxidase mimic for colorimetric and visual determination of glucose." Microchimica Acta 186.7 (2019): 1-10.
- 26. Ma, Weishuai, et al. "Clinically colorimetric diagnostics of blood glucose levels based on vanadium oxide quantum dots enzyme mimics." Microchemical Journal 153 (2020): 104352.https://doi.org/10.1016/j.microc.2019.104352
- 25. Wang, X., Liu, Z., Zhao, W. et al. A novel switchable fluorescent sensor for facile and highly sensitive detection of alkaline phosphatase activity in a water environment with gold/silver nanoclusters. Anal Bioanal Chem 411, 1009–1017 (2019). https://doi.o
- 24. Niu, Meng, et al. "Comparative study on protein polymerization in whole-wheat dough modified by transglutaminase and glucose oxidase." LWT 90 (2018): 323-330.https://doi.org/10.1016/j.lwt.2017.12.046
- 23. Meng-Meng Liu, Xin Lian, Hui Liu, Zi-Zhen Guo, Hui-Hong Huang, Yun Lei, Hua-Ping Peng, Wei Chen, Xin-Hua Lin, Ai-Lin Liu, Xing-Hua Xia, A colorimetric assay for sensitive detection of hydrogen peroxide and glucose in microfluidic paper-based analytical dev
- 22. Xie, Siqi, et al. "AIE-active metal–organic frameworks: facile preparation, tunable light emission, ultrasensitive sensing of copper (ii) and visual fluorescence detection of glucose." Journal of Materials Chemistry C 8.30 (2020): 10408-10415.DOI https://d
- 21. Liu, Tingting, et al. "Facile strategy to prepare a metalloporphyrin-based hydrophilic porous organic polymer with enhanced peroxidase-like activity and high stability for colorimetric detection of H2O2 and glucose." Colloids and Surfaces B: Biointerfaces
- 20. Liu, Wei, et al. "Fluorometric and colorimetric sensor array for discrimination of glucose using enzymatic-triggered dual-signal system consisting of Au@ Ag nanoparticles and carbon nanodots." Sensors and Actuators B: Chemical 265 (2018): 310-317.https://d
- 19. Qi, Guohua, et al. "Glucose oxidase probe as a surface-enhanced Raman scattering sensor for glucose." Analytical and bioanalytical chemistry 408.26 (2016): 7513-7520.
- 18. Xiao, Fan, et al. "Gluten development and water distribution in bread dough influenced by bran components and glucose oxidase." LWT 137 (2021): 110427.https://doi.org/10.1016/j.lwt.2020.110427
- 17. Yu, Dalong, et al. "Iodophenol blue-enhanced luminol chemiluminescence and its application to hydrogen peroxide and glucose detection." Talanta 146 (2016): 655-661.https://doi.org/10.1016/j.talanta.2015.06.059
- 16. Cheng, Xiqing, et al. "Metal–Organic Framework as a Compartmentalized Integrated Nanozyme Reactor to Enable High-Performance Cascade Reactions for Glucose Detection." ACS Sustainable Chemistry & Engineering 8.48 (2020): 17783-17790.https://doi.org/10.1021/
- 15. Cheng, X., Zhou, J., Chen, J. et al. One-step synthesis of thermally stable artificial multienzyme cascade system for efficient enzymatic electrochemical detection. Nano Res. 12, 3031–3036 (2019). https://doi.org/10.1007/s12274-019-2548-8
- 14. Qu, Fei, et al. "Fluorescent Detection of 2, 4-Dichlorophenoxyacetic Acid in Food Samples Based on Covalent Organic Frameworks and MnO 2 Nanosheets." Food Analytical Methods 13.10 (2020): 1842-1851.https://doi.org/10.1007/s12161-020-01807-2
- 13. 田双起,张锦霞,胡浩杰,王新伟,王彦波.远红外制备甘薯生全粉对面团流变学特性影响[J].食品工业,2020,41(09):55-59.
- 12. 孔晓雪, 李蕴涵, 李柚,等. 葡萄糖氧化酶和谷氨酰胺转氨酶对发酵麦麸面团加工品质的影响[J]. 食品工业科技, 2019, 40(9).
- 11. 王新坤, 刘超, 杨清梅,等. 青稞籽粒β-葡聚糖含量及不同加工方式对其变化的影响[J]. 山东农业科学, 2019, 051(002):124-130.
- 10. 王新坤, 王月明, 刘超,等. 青稞碳水化合物构成与血糖稳定品质的关系[J]. 中国粮油学报, 2019(8):34-41.
- 9. 孔亚访, 樊爱萍. 金纳米簇增强的化学发光反应及在葡萄糖检测中的应用[J]. 分析科学学报, 2018.
- 8. 沈王庆, 陈蓉, 赵秀蓉,等. 葡萄糖氧化酶和柠檬汁对甘蔗汁保鲜效果的研究[J]. 天然产物研究与开发, 2016(28):1533.
- 7. 王菲菲, 高山, 牟德华. 脱糖方式对山楂中特征成分含量的影响[J]. 食品工业, 2020(3):170-175.
- 6. 常波, 叶丹, 王敏,等. 磁性碳纳米管修饰POD-GOD双酶系统葡萄糖传感器的研究[J]. 成都师范学院学报, 2018, 034(009):96-103.
- 5. 熊俐, 曹新志, 吕开斌,等. 复合菌和酶制剂在麸皮面包品质改良上的应用[J]. 食品研究与开发, 2013, 000(016):22-25.
- 4. 王誉涵, 林家亮, 徐宏. 基于一种新型二茂铁修饰方法的葡萄糖氧化酶电极研究[J]. 分析试验室, 2018, 37(12):1380-1383.
- 3. 向宇 鲁群 谭军 张久亮 刘睿 朱和平.响应面分析优化枸杞浑浊汁饮料稳定工艺研究[J].核农学报 2017 31(11):2154-2163.
- 2. 周冉 宋玉品 刘晓妹 等. 仿生硅化固定化葡萄糖氧化酶与辣根过氧化酶研究[J]. 食品工业科技 2017 38(002):221-225.
- 1. 张志国 王硕 生庆海.HPLC-ELSD法检测液态奶中的低聚半乳糖[J].食品与机械 2011 27(03):68-70+75.







 浙公网安备 33010802013016号
浙公网安备 33010802013016号